时间:2022-09-09 09:15:22
开篇:写作不仅是一种记录,更是一种创造,它让我们能够捕捉那些稍纵即逝的灵感,将它们永久地定格在纸上。下面是小编精心整理的12篇药物临床试验,希望这些内容能成为您创作过程中的良师益友,陪伴您不断探索和进步。
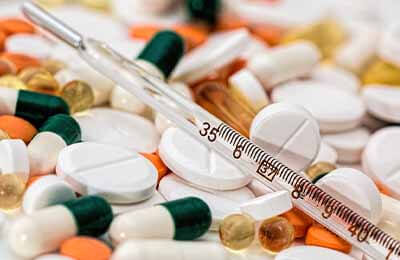
药物临床试验档案的专业性相对较强。药物临床试验档案能够初步评价出药物对人体的安全性,检测出人体体内的抗药能力并促进药代动力学的进一步研究,为制药方提供了有效的临床依据。药物临床试验档案在临床治疗中属于评价阶段,其作用是对药品使用者进行用药评价并进行相关记录,通过试验结果确定药品的可用性和安全性,明确用药风险,为药品申请生产提供有效信息。药物临床试验是由申请人自愿参加药品应用型研究,其目的是为了监测药品的临床效果以及药品使用后的相关不良反应,评价普通患者和特殊患者使用药物的经济能力和安全性。在试验结果的基础上,尽可能减少患者药品用量,降低患者体内的抗药性[1]。药物临床试验档案应分类保存并保证其信息的完整性。药物临床试验档案的原始资料较为复杂且信息量较大,在管理药物临床试验档案时,要有序的整理档案确保药物临床试验档案的完整性、安全性、可靠性,将药物临床试验档案完好无损的保存在档案室。信息记录人员要保证试药者信息的保密性,保护一手资料,从源头上杜绝试药者信息的外漏。试药者的个人信息、新型药品的处方、药品的制作工艺等都受法律保护,其保密性具有相应的法律效应。药物临床试验部门应该申请信息的保护,实验的相关资料只对国家药监机构、临床试药部门、申办方开放,不得私自将信息外泄[2]。
药物临床试验档案管理的现状和对策
目前我国存储档案空间不充裕,大量的临床资料虽然会保存在电子档案中,但是大量的原始资料和纸质版档案仍然需要巨大的档案存储空间。每一位试药者,其体检结果、用药时间、用药剂量、临床效果等信息都要进行详细的记录并存储于档案室,这就要求档案管理部门提供足够大的档案存储空间,档案存储空间有限是目前需要解决的问题之一。随着科技的发展,医疗记录水平也在不断提高,电子病历需要进一步的升级,实现原始病例的电子录入并实现新技术的普及。有效的对药物临床试验档案进行管理,电子档案和数字化档案逐渐取代纸质版档案,在降低对档案存储空间的同时,也实现了高效的档案调取和档案管理[3]。科学技术与医疗管理相结合,实现高效管理药物临床试验档案。临床试药的时间相对较长,长时间高频率的记录就提高了对于管理的有效性的要求。长时间高频率的记录信息就要求信息采集者具有^高的责任心,同时应具有足够的耐心和细心,仔细整理档案并保存。信息的收集是药物临床试验档案管理的重点,也是药物临床试验档案管理的基础。只有清晰的收集到信息,才能对药物临床试验档案进行高效的管理。与此同时,档案管理人员还要重视药物临床试验后试验结果的总结,并对信息采集不足之处进行及时的补充。
管理药物临床试验档案的工作人员需要有较高的相关专业知识、具有责任心且有一定的管理能力[4]。在试药者用药之前,试药者必须做全身检查,确保其身体条件符合试药要求。药物临床试验档案管理人员必须按照国家的相关规定对现有档案进行管理,规范药物临床试验档案的管理流程,重视原始信息的收集,保证其真实性和安全性。管理人员在其工作中不仅要细心仔细,还要具有不断学习的精神,不断提高自身的管理能力,进而促进药物临床试验档案的有效管理,为医学研究事业提供有效的信息,加快我国医疗产业的发展[5]。
参考文献:
[1] 杜彦萍,黄习文,杨忠奇,等. 药物临床试验档案管理[J]. 中国中医药现代远程教育,2011,09(5):135-136.
[2] 吴建元,邹晓h,黄建英,等. 机构办公室加强药物临床试验规范化管理探讨[J]. 中华医学科研管理杂志,2011,24(2):86-89.
[3] 徐莉娅,陈燕溪,杨林芬,等. 浅析药物临床试验档案管理现状及对策[J]. 中国中医药现代远程教育,2016,14(13):35-37.
疾病作为危害人体健康的一个重要因素,而在疾病治疗过程中,药物治疗对疾病患者的健康有着重大作用,然而药物的安全性与否直接关系到疾病治疗效率,进而影响到患者的生命健康。药物临床试验作为评价药物疗效及安全性的重要工作,药物临床试验质量管理工作直接关系到患者的治疗。临床试验是新药研究开发的必经阶段,对评价新药的疗效和安全性起着无可替代的作用,其研究资料和结果是药品监督管理部门进行新药审批的重要内容和关键依据。因此,在药物临床试验中,医院及相关部门就必须加强药物临床试验质量管理,不断提高药物临床试验质量,进而为广大患者的生命健康提供保障。
2加强药物临床试验质量管理的措施
2.1加强设备管理
在药物临床试验中,设备的应用有着重大作用,然而设备也是影响临床试验质量的一个重要因素。为了确保临床试验质量,医院就必须做好设备管理工作,对设备实现现代化管理,建立一个全面的质量管理体系。对于一些机器容量小、电源条件差的问题,可以配置稀土增感屏进行弥补,确保设备处于无菌状态。
2.2加强人员的培训与管理
药物临床试验质量管理工作人员素质的高低、文化水平都将影响到临床试验质量。就目前来看,我国当前药物临床试验质量专业管理人员比较匮乏么,缺乏责任心和责任意识,在实际工作中不能认真对待,进而威胁到临床试验质量。为此,医院及相关部门必须重视药物临床试验质量管理工作人员的培训与管理,不仅要加强工作人员的专业素质及专业知识的培养,同时还要不断加强他们的责任心和责任意识,提高他们对药物临床试验质量控制的重要性的认识。另外,医院要定期组织学习,培训防护措施,将药物临床试验相关操作标准张贴出来,供工作人员阅读,进而减少失误。
2.3建立统一的监控系统
药物临床试验作为一项重要的工作,药物临床试验质量管理工作不仅关系到医院的发展,同时也关系到患者的健康。为此,医院及相关部门在药物临床试验工作中就必须狠抓质量管理工作,在药物临床试验工作中建立完善的组织管理机构,形成科学、有效的管理体制和运行机制,有利于强化试验管理和保证试验质量。通过计算机网络操作来降低人为失误,进而提高试验的准确率。同时,利用计算机网络对药物临床试验每一个工作环节进行系统监控,以程序化、系统化的管理模式来保证岗位责任制的合理落实,进而确保临床试验质量。
2.4完善管理制度
确保药物临床试验质量是我国当代医疗事业发展的一项重要内容,药物临床试验质量工直接影响到了医院的发展及病患的健康。为了进一步提高医院医疗水平,促进患者的健康,在药物临床试验质量管理工作中,就必须落实各项管理制度。医院要遵循国际公认的《药物临床试验质量管理规范》,以制度来规范行为,规章制度是工作的标准和依据,制度的落实使工作质量的保证。在药物临床试验质量管理工作中,只有完善管理制度,规范操作行为,使各个环节都处于可调节、可控制范围内,才能确保临床试验质量,进而为患者的健康提供保障。
3结语
儿童临床试验缺乏导致的用药不当或无药可用是全球性的问题,已经引起了很多国家的重视。美国食品和药品管理局(FDA)为了鼓励药厂进行儿童临床试验,1997年11月在《食品药品管理现代化法案》(Food and Drug Administration Modernization Act)中明确了增加6个月专利保护期的优惠政策,所以药厂申请儿童制剂的临床试验明显增多[1]。日本厚生省医药安全局于2000年12月颁布了《儿童药品临床试验指南》(Clinical Investigation of Medicinal Products in the Pediatric Population),并实行延长药品复审年限的政策以鼓励制药企业从事儿童药物临床试验[2]。欧盟于2007年1月《儿童用药管理规定》(Pediatric Regulation),规定所有新药申请必须有儿童试验计划(pediatric investigation plan,PIP),自2009年1月26日起,新适应证申请也必须包括PIP[3]。
我国的儿科药理基地建设于上世纪八十年代开始启动。1983~1990年间,为了提高药品临床试验的科研技术水平,卫生部先后分三批批准了35个临床药理基地共计114个专业科室,包括西医儿科和中医儿科专业各1个[4,5]。1998年8月,国家食品药品监督管理局(SFDA)正式成立,重新确认了121个国家药品临床研究基地(国药管安[1999]272号),共计561个专业,其中包括9个中医儿科专业。2004年2月,SFDA出台了《药物临床试验机构资格认定办法(试行)》(国食药监安[2004]44号),对申请药物临床试验机构资格认定的医疗机构进行检查,同时对老基地进行复查。根据SFDA的公告,截至2009年7月14日,获得药物临床试验资格认定的儿科专业增加到了46个,但 周鹍,儿科学硕士,主治医师。1997年毕业于北京中医药大学获学士学位;1997~2000年在云南省第一人民医院从事临床工作;2003年获中西医结合儿科临床硕士学位;2003年至今就职于北京中医药大学东方医院,现为北京中医药大学东方医院药物临床试验机构办公室秘书、临床研究伦理委员会秘书。参与药物临床试验机构资格认定申报与复审工作,熟悉国内外药物临床试验相关法规,具有丰富的临床试验项目管理及临床研究伦理审查经验,主持和参加相关科研课题研究,发表了多篇学术论文。主要研究领域:临床研究及伦理审查关键文件设计规范研究。
仅占获得资格认定专业数的2.4%[6],仍然远远不能满足约占患病总人口20%的患病儿童的需求。同时,各专业的数量分布不均,包括中医儿科16个,小儿呼吸专业9个,小儿肾病、内分泌、神经病学、感染专业各3个,小儿消化、心脏病专业各2个,小儿血液病、皮肤、肿瘤、遗传代谢、普通外科专业各1个,大部分专业数量较少,还达不到临床试验应在多中心实施的基本要求。因此,亟需加强对儿童药物临床试验的鼓励和扶持。
1 儿童药物临床试验的重要性
1.1 儿童不是缩小的成人
儿童处于生长发育阶段,特别是婴幼儿时期肝肾功能、中枢神经系统和内分泌系统的发育尚不健全,药物在其体内呈现的药代动力学和药效动力学与成人有较大差别;对许多药物的代谢、排泄和耐受性较差,药品不良反应发生率比较高。由于缺乏临床疗效和安全性数据,很多药物没有针对儿童的剂型,儿科未获得许可(unlicenced)及标签外(offlabel)用药非常普遍[7],临床医生多简单地以成人用量进行折算,忽视了儿童独特的生理、病理情况及药动学和药效学特点,导致儿童用药不良反应的增加。
1.2 成人疾病发病日益低龄化
随着2型糖尿病、高血压、高脂血症、抑郁症等疾病在儿童中的发病率日趋增高,之前只用于成年人的药物,现在也越来越多地应用于儿童。据报道,2002~2005年间,口服降糖药物的使用在青少年男性中增加了39%,在青少年女性中增加了166%;降脂药物的使用在儿科患者中也增加了15%,其中主要是他汀类药物[8]。但是,这些药物在儿童中应用的经验很有限,治疗的时机也还不明确。另外,早在2004年FDA就首次警示,儿童和青少年使用抗抑郁药物有增加自杀倾向的风险,然而不予以确诊的抑郁症患儿药物治疗又不符合医学伦理,抗抑郁药物在低龄人群中使用的安全性还需要严格的临床试验来验证。可见,对儿科药物临床试验的需求已经迫在眉睫。
2 儿童药物临床试验的特殊性
儿童属于弱势人群,参加临床试验面临的风险较高,对此,欧盟公布的《儿童临床试验伦理标准建议》指出,“儿童的利益应高于科学与社会”[9]。为了保护儿童的利益,使他们免受伤害,在设计儿童临床试验时需要考虑一些特殊的伦理问题。
2.1 医学伦理规范性文件中的特别规定
《赫尔辛基宣言》(2008修订版)中有关儿童临床试验的规定:对无行为能力的受试者,研究人员必须取得其法定监护人的同意。除非研究对促进上述人群的健康是必须的且无法在具备行为能力的受试者中进行,同时研究的风险和负担极低,否则不可以进行研究。若受试者被视为无行为能力,但能表达是否同意参加研究的决定时,医师除了应取得该受试者法定监护人的同意外,也必须取得其本人的同意。应该尊重无行为能力受试者不赞同的意见[10]。
国际医学科学组织委员会于2002年8月对“人体生物医学研究国际道德指南”进行了第3次修订,规定在进行涉及儿童的研究之前,研究者必须确保:(1)以成人为受试对象,研究不能同样有效地进行;(2)研究的目的是获得有关儿童健康需要的知识;(3)每位儿童的父母或法定监护人给予了许可;(4)已获得每位儿童在其能力范围内所给予的同意(赞成);(5)儿童拒绝参加、或拒绝继续参加研究将得到尊重[11]。
我国的《药物临床试验质量管理规范(局令第3号)》(GCP)第十五条规定:儿童作为受试者,必须征得其法定监护人的知情同意并签署知情同意书,当儿童能做出参加研究的决定时,还必须征得其本人同意。
上述规范性文件均强调:儿童临床试验必须获得儿童受试者法定监护人签署的知情同意书,研究者同时应根据儿童年龄在其所能理解的范围内告知受试儿童并取得其同意。儿童对于中止某项与研究相关的操作和退出研究的愿望应受到充分尊重。
2.2 试验设计的顺序
鉴于儿童的弱点,必须努力降低已知的危害,一般应首先在动物中进行安全性研究,然后按照成人、年长儿童、年幼儿童的顺序进行研究。有些特殊情况允许直接进行儿童研究,例如:①研究是针对威胁儿童生命的情况;②有些儿童特发性疾病,如影响婴儿的神经母细胞瘤,患儿无法活到年长儿童期[12]。
2.3 试验设计的原则
儿童临床试验方案并不是成人试验方案的简单重复,应由具备儿童工作经验的研究者精心设计,遵循风险和不适、痛苦最小化的原则[9]。
2.3.1 风险最小化的具体措施 在临床试验开始之前,研究者应该全面了解试验药物的毒性,尽最大努力预测并减少已知风险;所有的研究人员必须具有丰富的儿童临床试验研究经验并接受适当的培训;设计满足统计学要求的最小受试者数,避免更多的儿童暴露于研究;在给予标准治疗的基础上使用安慰剂,并要事先规定解救和退出试验的情况和措施;成立专门的数据和安全监察委员会以实时监测药物的不良反应;应有完善的急救设备和应急措施,确保突发严重不良反应或未预期伤害时能够迅速应对。
2.3.2 不适和痛苦最小化的具体措施 试验应尽可能在儿童熟悉的环境中进行,摆放与儿童年龄相适应的体育设施、游戏设备以及食品等;尽量减少采血量:寻求适当的检测方法(如放射免疫测定法、高效液相色谱法、质谱法等可检测少到20~100 μL的血样),或采用测定尿液、唾液等非侵入性样本收集方法;采取减少研究干预引起不适的措施:如静脉穿刺时使用局部麻醉药,多次抽血时使用留置针;侵入性检查治疗应该由有经验的人员实施,以减少儿童受试者的痛苦;为了减少儿童的焦虑和预期的痛苦,研究者在进行任何一项检查或程序之前,都应该用适合其年龄的诚实而非恐吓性的语言予以解释说明;任何能引起儿童羞耻感的程序,例如需要衣服进行检查,应该尽量避免,否则应事先告知儿童并注意保护其隐私;要尽量避免儿童与家长或熟悉的照顾者之间的分离,如果不能避免,儿童的父母或监护人应有机会适度地观察研究的进行并保持与儿童的密切联系。
3 讨论
鉴于儿童药物临床试验特殊而严格的伦理要求,加之招募儿童受试者非常困难,导致儿童药物临床试验的发展举步维艰。但是,如果没有儿童参与临床试验,就不可能制定出对儿童安全有效的用药指南,开展高质量且符合伦理的临床试验是保障儿童用药安全的关键环节。我国目前开展的儿童临床试验数量有限,儿童专用新药的自主研发能力相对较弱,国内很多药物在上报审批时还依赖于国外的儿童临床试验资料。然而,国外儿童的体质与我国儿童不同,临床研究结果可能存在差异,完全照搬会存在风险。因此,我国亟需借鉴发达国家经验并结合本国国情,积极改善目前儿童临床试验的薄弱现状。
3.1 采取强制与鼓励相结合的政策
从发达国家的经验来看,政府在促进儿童药物临床研究的发展中起主导作用。2005年我国1%人口抽样调查主要数据公报显示:全国人口中0~14岁的人口为26 478万人,占总人口的20.27%,而市场上常见的3 500多个药物制剂品种中,儿童药物剂型只有60多种,仅占1.52%[13]。少年儿童是祖国的未来,政府应高度重视儿童群体的用药安全问题。相关部门一方面可强制制药企业对申请注册的部分新药进行儿童临床试验,另一方面也要出台研发儿童药物的优惠政策,例如儿童临床试验及新药注册的优先审批权,延长儿童新药的专利保护期,从政府渠道投入创制儿童新药的科研经费等,以激励企业和专业人员从事儿童药物研究。
3.2 成立儿科临床药理学专业学术团体
儿科临床药理学是直接关系到儿科医学与儿科药学发展的重要桥梁学科,是实施GCP和促进新药开发所必须的基础知识和应用理论及方法。成立儿科临床药理学的专业学术团体,能积聚儿科医师、药师和相关学科人员的力量,建立学术交流的平台,有利于发掘和培养专业骨干;可协助政府相关部门起草儿童药物临床试验的要求、内容、观察指标及临床评价原则,相关的指南,使儿童药物临床研究达到规范化的要求;同时还承担对从事新药临床研究的医生进行临床药理知识培训的任务,从而促进儿童药物临床研究整体水平的提高。
3.3 成立地区性或区域性儿童伦理委员会
儿童临床试验方案必须经过伦理委员会审查通过方能实施,该伦理委员会应该具备有关儿童医学、药学、护理学、伦理学、心理学等方面知识和经验的专家,能正确评价试验对于儿童受试者的风险和受益,审查临床试验方案是否符合科学和伦理要求。目前各药物临床试验基地均成立了机构伦理委员会,但各机构伦理委员会尚缺乏具有丰富儿童工作经验的专家,因此有必要整合人才资源,成立地区性或区域性儿童伦理委员会,对本区域内拟开展的儿童药物临床试验进行审查,更好地保护儿童受试者的权益。
3.4 建立儿童临床试验官方网站
利用网络技术,系统登记已批准进行的儿童临床试验并及时公布试验结果(包括不利的研究结果),对文献资料的全面分析结果也要公布,以便研究人员查询到有类似目的、类似临床试验的相关信息,避免重复进行临床试验[9]。儿童临床试验网站的建立还能为患病儿童及其家长提供新药研究的信息,同时宣传儿童临床试验的重要性,有助于招募受试者,使更多的患病儿童受益。
参考文献
[1] fda.gov/downloads/Drugs/DevelopmentApproval Process/DevelopmentResources/UCM049915.pdf.
[2] Akiyoshi Uchiyama. Pediatric Clinical Studies in Japan: Regulations and Current Status. Applied Clinical Trials, Jul 1,2002 [EB/OL]. appliedclinicaltrialsonline.findpharma.com.
[3] ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol1_en.htm#reg1901.
[4] 傅俊一. 卫生部组建十四个药品临床药理基地. 中国卫生年鉴[M] . 北京: 人民卫生出版社, 1984: 265267.
[5] 傅俊一. 卫生部建立第二批临床药理基地. 中国卫生年鉴[M] . 北京: 人民卫生出版社, 1987: 235.
[6] sfda.gov.cn/WS01/CL0069/.
[7] Roberts R, Rodriguez W, Murphy D, et al. Pediatric drug labeling: improving the safety and efficacy of pediatric therapies [J]. JAMA, 2003, 290(7): 905911.
[8] 梁 伟, 编译. 儿童用药临床研究迫在眉睫[J]. 中国处方药, 2008, (4): 1819.
[9] European Union. Ethical considerations for clinical trials on medicinal products conducted with the pediatric population.[J].European journal of health law, 2008, 15(2) : 223250.
[10] Declaration of Helsinki. World Medical Association [EB/OL]. wma.net/e/ethicsunit/helsinki.htm.
[11]卜擎燕, 熊宁宁, 吴 静. 人体生物医学研究国际道德指南[J]. 中国临床药理学与治疗学, 2003, 8(1): 107110.
关键词:药物临床试验;项目;进度延误;影响因素
中图分类号:TB文献标识码:A文章编号:1672-3198(2013)08-0185-02
药物研发是一个漫长的过程。在美国平均一个新药的上市需要8-10年,花费约10-12亿美元,而其中更是有超过三分之二的时间和金钱消耗在药物临床试验方面。对于制药企业而言,新药研发是高昂的风险承担,而新药一旦上市所获得的收益也是相当可观。为此如何能进一步的缩短新药研发,尽快上市对制药企业来说极为重要。企业对作为新药研发的主要精力“消耗者”――临床试验的态度更是非常坚决,尽可能使临床试验的时间能尽可能控制在其预期进度之内。为此分析可能导致临床试验进度延误的影响因素是制药企业尤为关注的问题。
1药物临床试验项目复杂性分析
药物临床试验具有高昂成本投入和较高风险承担的特征,同时也是一个非常典型的多主体、多事务的复杂项目体系。一般制药企业完成临床前研究,经过药政部门的审批后,从而申请临床试验,被称为申办者,是整个临床试验的牵头主体;然而临床试验的具体操作是由临床试验机构的以医生为核心的研究者团队实施的,并由研究者负责招募受试者进行试验;同时为符合伦理学和对受试者的保护,绝大部分临床试验事务需要经过伦理委员会的审批。
申办者通常会选择一名项目经理负责整个临床试验项目的管理,项目需要各种不同技能的协助,需要组成良好的团队进行配合方能完成好试验。临床试验项目事务主要体现在以下方面:(1)项目管理事务:试验计划书的制定与试验项目的监察;(2)财务管理:临床试验项目的预算制定与调整以及费用的报销;(3)药物供应管理:保证符合GMP的足量高质的试验药物的供应;(4)药政事务:符合药政部门要求的方案申请;(5)数据管理:试验数据的录入、分析与管理;(6)合同法律事务:与参与试验的合同研究组织(CRO)的合同签订。而研究者作为试验的实施者,是整个项目中的核心组成。研究者负责试验操作,而研究协调员负责伦理委员会材料的申报、与申办者或CRO的事务联系等一系列项目细则(图1)。以上分析可知,临床试验项目涉及主体众多,事务繁杂,其进度延误可能有多方面的可能原因,有待进一步分析。
图1药物临床试验的申办者及研究者团队及职能2药物临床试验项目阶段分析
2.1药物临床试验项目阶段简介
虽然研究者作为临床试验的核心,但是大部分临床试验项目事务是由申办者完成的,且需要申办者投入大量的财政和人力。一般临床试验的项目阶段可分为计划、启动、实施、完成四大部分,主要事务如图2所示。其中需要注意的是第一位受试者入组与最后一位受试者完成试验通常作为试验实施阶段的起始标志;同时试验方案书、知情同意书、研究者手册、预算、招募广告等文件均需要递交伦理委员会审核批准。而申办者对临床试验的时间预期也可认为是从计划到完成阶段的全部时间,在研究方案中通常会有一个经验性的预估期限。
图2临床试验项目阶段事务图如果试验均按照方案平稳进展,通常试验能按照进度或者提前完成;而实际与预期总会存在一定的差距,大部分临床试验都会发生一定的进度延误。
2.2药物临床试验项目关键节点分析
假设申办者能够通过完善自身的规章制度、设置奖惩等措施提高团队效率,从而保证涉及申办者的事务能够按照计划完成,那么可以得出这样的结论:临床试验项目进度是否能够符合计划关键在于申办者与其他机构或组织之间事务的进展情况,即为项目进度中的关键节点。
为此分析临床试验阶段中其他参与主体的参与事务,可以大致得出哪些关键节点,从而进行进一步分析。结合临床试验阶段事务,可得主要其他参与主体有:伦理委员会、研究机构、受试者、合同研究组织(CRO)。结合项目阶段分析可得伦理委员会的审批、受试者的招募、研究者试验进展以及与CRO的合同事务磋商将是申办者无法通过自身效率提升而改变时间的主要事务,即为项目进度中的关键节点,也是可能的导致进度延误的影响因素。
3可能导致临床试验进度延误的因素分析及对应措施
3.1伦理委员会审批延误
临床试验在每一个研究机构的启动均需要伦理委员会的书面批准,同时临床试验方案书等一系列文件均需要通过审批。为此尽快获得伦理委员会的批准对项目能够符合进度非常重要。伦理委员会审批延误主要是由于研究者准备材料不够充分、伦理委员会对试验项目方案有较多的疑问、会议议题较多而导致推迟至下次会议、会期间隔过长而当次会议无法解决所有问题推至下次会议。
对此可能导致的进度延误因素,主要措施是(1)申办者首先要做好充分的项目调研,并对伦理委员会的会期有充分的了解;(2)与研究者之间要有及时的联络,掌握申请材料的准备情况并以充足的准备应对伦理委员会的问题;(3)对于需要修正的文件应当与研究者共同及时地改正。
3.2受试者招募比预期困难
根据Lasagna法则,研究者的预测招募率总是大于现实招募率。主要原因无外于研究者对自己的受试者资源过于乐观或者受试者不愿意参加试验而导致招募时间延长;同时不同研究机构招募率的差异也会影响整个项目的进程。高招募率与低招募率的研究机构招募受试者的速率有可能相差十倍。如果申办者对试验项目的可行性研究或者选择研究机构的环境研究不够充分,如存在竞争性项目等情况,势必会影响到受试者的招募情况,从而影响项目进度。此外,若是受试者脱落情况较多,数据难以达到统计学要求,不得不再次进行补充招募不仅会影响项目进度,同时也意味着试验前期这部分受试者身上的投入的白费。
对招募情况的改善措施主要在于以下几个方面:(1)对临床试验项目要有充分的可行性调查,对各研究机构要有初步的审查,尽量避免竞争项目存在的研究机构以及地理或当地文化环境不利于受试者招募的机构;(2)准确地掌握各研究机构的招募情况,及时发现研究机构的招募困境,并做出相应的策略调整,如增加新的研究机构、关闭招募不利的研究机构等;(3)试验准备阶段应重视招募措施的使用,如以邮件或者电话的形式欢迎受试者入组、为受试者提供一些有关健康的建议等;试验开展阶段申办者应派出监查员与受试者进行交流,并给予关怀与尽可能的方便,在节日中提供一些特别的小礼物等,有利于受试者能够坚持完成试验尽量避免不必要的脱落。
3.3合同磋商事务的拖延
CRO在临床试验事务中占有重要的地位,有数据表明,CRO参与的临床试验平均可以缩短约三分之一的时间,同时为试验引入专业化的系统或工具。然而CRO的加入同时也为申办者的管理带来一定的不便,如何协调自身和CRO的工作是非常核心的问题。如果出现合同磋商的时间延误,可能的原因有两个方面:(1)CRO未能按照合同要求按时完成试验,一方面直接影响试验进度,另一方面也增加企业与CRO之间的沟通成本和合同磋商成本,进一步影响试验进展;(2)试验中出现某些突发状况而导致合同需要进行修改或者出现质量瑕疵,导致合同磋商拖延进度情形的出现。
为此,申办者在选择CRO公司时,应当综合多方面因素,不能仅仅以预算高低作为唯一的衡量指标。一般情况下,选取3-4家CRO公司作为候选,要求候选公司提交服务标书,并进行现场介绍与答辩,最后综合CRO的硬件技术能力、服务态度、人员水平、稳定性与经验、诚信度、企业对其控制力、预算等一系列指标遴选出适合企业协调控制、能够高效完成项目的CRO。在选择之后需要对其进行稽查才能最终签署合同,合同中需要对双方的职能、完成时限、资源配备、沟通频次等有明确的规定。在试验进展期间,申办者应与CRO举行定期试验项目进展会议或者要求申办者定期提供项目进展报告以确保其工作符合申办者的要求,并可以及时解决试验中可能出现的问题并掌握项目的进展情况。
4结语
新药是否能够尽快上市关系到制药企业的利润收入以及整个研发体系的可持续发展。为此如何能保证新药研发中耗时最长的临床试验的进度符合预期是制药企业的重要难题。本文笔者仅从临床试验项目中申办者之外的参与主体角度分析可能存在的项目进度延误的部分影响因素,并对此提出制药企业的相应管理措施;对企业自身以及其他可能因素的研究尚有不足,还有待进一步的实践研究。
参考文献
[1]阿丽塔,田玲.合同研究组织的发展及我国应采取的对策[J].医学信息学杂志,2008,(5):29-33.
[2]刘川.药物临床试验方法学[M].北京:化学工业出版社,2011.
[3]范大超.受试者有效招募及影响因素[J].中国处方药,2010,1(94):70-71.
关键词: 受试者管理;招募;脱落;依从性;风险
中图分类号: D9
文献标识码: A
文章编号: 16723198(2013)06014003
近年来我国药物临床试验以40%的速度增长,超过60家跨国企业在中国开展临床试验,RDPAC成员企业中超过15家在中国设立不同职能的研发中心,同时国内制药企业也在逐步重视研发,越来越多的药物进入临床试验。
药物临床试验是指新的药物在临床评价其疗效的过程,通常包括Ⅰ~Ⅳ期,每期都有不同的目的、试验人群和试验方法。药品本身即带有一定的风险属性,而新药未经过大面积的临床使用,对其不良反应的了解也不够深入;再者,临床试验项目涉及多主体,不同主体对项目有不同的理解与预期,种种因素导致临床试验的高风险。从临床试验项目的管理和质量角度看,最为关键和困难的环节就是受试者的管理,包括受试者的招募、留置和确保受试者对临床实验方案的依从性等。为此,如何有效管理受试者,控制风险以达到试验目的是临床试验非常核心的环节。
1 受试者招募环节中的风险因素分析
1.1 招募时间风险
受试者的招募能否达到预期,是制药企业最为关注的问题。试验进度的延长将延后新药的上市,带来巨大的经济损失。而在我国,目前的研发体系以仿制及其优化为主,产品面临巨大的竞争压力,如何尽快招募到合适的受试者即成为制药企业的共同目标。
1.2 招募策略不合理风险
在当今的临床试验领域,制定更好的招募策略、实施更加有针对性的受试者招募手段会增加病人对临床试验意义的认识与其日常生活保健的了解,从而提高病人入组的几率,对临床试验项目的成功会有很大的帮助。因此如何制定良好的招募策略也成为临床试验方案设计、申办者招标合同研究组织的重要问题。
1.3 招募环节研究者相关风险
1.3.1 过高的招募预测
根据一项研究显示,美国超过80%的临床试验未能达到试验进度的要求,其中绝大部分的延长是因为未能找到足够数量的受试者。受试者招募中存在著名的Lasagna法则(如图1):研究者预测招募率总是比现实招募率要大得多。主要是研究者过于乐观估计自己的受试者资源或者受试者主观或客观上不能参加试验而不得不延长招募时间窗。
1.3.2 职能重合风险
我国药物临床试验在临床试验基地开展,当前医疗体制导致基地绝大部分与公立医院重合,不同于国外有相当比重的试验是由私人研究者完成的,因而研究者面临着试验研究与日常医疗工作的重合;同时我国的伦理委员会大多挂靠基地下,委员会主任通常是医院院长或是“学科带头人”,在试验负责人与伦理委员会委员身份重合以至于审查结果受研究者行政权力的制约,在招募中有失公平。
而试验研究者与医生职能存在重合,而受试者担忧拒绝参加试验会影响医生对其医疗态度而勉强答应,未能做到真正意义的知情同意。此类受试者是否能够完成试验值得进一步思量。
1.3.3 竞争性风险
我国临床基地研究人员通常承担着一定的医疗、科研或教学任务。我国临床试验数目增长很快,而我国的文化影响在临床试验中表现为多偏好邀请“学科带头人”以示重视和信赖。为此部分临床试验基地承担着较重的临床业务以及多项临床试验项目,尤其当同时参与的项目集中于同一适应症,研究者能否平衡时间与精力或者在承担多项社会工作之后能否重视临床试验,这些都值得商榷。
2 受试者脱落风险分析
成功招募受试者进入临床试验项目仅仅是受试者管理工作的开始,任何试验项目都不可避免地面临受试者脱落。一般而言,受试者脱落主要分为两大类:受试者因为某些原因自行退出试验或研究者鉴于某些因素终止受试者参与试验。
2.1 受试者脱落的原因分析
2.1.1 研究者决定退出
研究者终止受试者参与试验大多出于医疗的考虑,比如疗效不佳、出现不良反应导致病人的身体状况难以继续承担试验项目;有些是由于受试者的原因使得研究者不得不将受试者剔除出试验,如受试者试验依从性较差、失去联络;还有可能是研究者自身的问题,如依从性较差而被申办者关闭,导致受试者被终止试验。
2.1.2 受试者自行退出
《药物临床试验管理规范》(以下简称GCP)赋予受试者随时以任何理由退出试验的权利。而受试者参与试验均能得到医疗或者金钱上的补助,大部分是倾向留在试验中,提前退出试验主要有以下原因:
(1)药物因素。
当疗效欠佳或存在不良反应时,除却研究者终止之外,受试者本身对试验的期望也在下降,退出的可能性提高。除此之外,药物的口感难以忍受或遵循试验已经成为生活负担,受试者也会选择自行退出。
(2)生活环境因素。
周围人包括家人或者朋友对受试者不够理解、对临床试验不够了解、外界媒体对受试者群体的报道,同时外界过多的牵绊例如家庭老弱需要照顾、交通不便、工作繁忙等都会对受试者继续试验的决心产生动摇。
(3)医疗环境因素。
我国公众对临床试验的理解普通较为片面,受试者参与临床试验大多存在一定的心理压力,而期望能在研究者方面获得理解并有相应的回报预期。而在医疗环境中,受试者的不愉快经历是临床试验中造成脱落的重要原因。当受试者每次访视都难以遇到熟悉的面孔、或者研究者对受试者态度恶劣、不够尊重、治疗不够严谨、研究者不愿意回答受试者的问题等都会在受试者心里留下不安,多次类似情况的发生会引发抵触心理,可能导致退出。
2.2 受试者脱落风险
每一位受试者中止试验都会带来多方面的影响:(1)受试者的离开意味着之前在此受试者身上花费的时间和精力的损失,同时也增加重新招募受试者所需要的时间与研究精力;(2)如果脱落人数较多,会进而影响试验项目的招募时间窗,从而影响项目进度;(3)而对盲性试验而言,脱落有可能导致双盲多治疗组别的不平衡,而这种不平衡对统计学意义的影响只能在破盲之后方能知晓,一旦引起真正统计学意义上的不平衡,可能对试验项目数据产生影响;(4)大面积的脱落会造成研究机构的研究热情降低,另一方面也会影响申办者对此研究机构的信心。
3 受试者非依从性风险分析
依从性是指对试验方案的执行度。临床试验的目的是评价药物的安全性和有效性,为获得准确的评价结果,受试者与研究者依从性是重要环节。受试者非依从性风险主要体现在受试者未按照试验方案服药而导致的风险。
3.1 受试者服药非依从性的原因
服药非依从性的主要原因与前文所述及的受试者脱落原因较为相似,如试验方案的繁杂而难以遵守、药物气味难以忍受、症状改善不明显或存在不良反应而停止服药、家人朋友的影响等多个方面。除此之外,年龄较大和受教育程度较低会导致受试者对方案的理解不充分,而导致忘记服药或服用其他禁忌药物。然而其中最重要的部分是研究者的态度恶劣,受试者出于抱怨而存在抵制心理。
3.2 受试者服药非依从性风险
受试者的非依从性可能造成累积有可能导致整个试验结果丧失完整性而无效,主要体现在以下方面:(1)可能会导致不良反应不能被及时发现;(2)可能会使得新药注册剂量产生过高或过低;(3)可能导致原本有效的统计数据归于无效,或者导致试验的假阳性或阴性,最终可能导致有效药物变成无效药物,或者无效药物被视为有效药物而上市。无论哪种情况对需要此种药物的患者都是不负责任的,且可能带来安全风险。
4 受试者管理中存在风险的应对
4.1 制定合适的招募策略
4.1.1 试验方案的完善
申办者和研究者只有将受试者的权益放在第一位,切实从受试者的角度考虑问题,才能成功完成招募预期,并保持受试者。因而试验方案制定过程应当将保护受试者权益放在首位,并针对受试者的偏好在合理范围内调整方案,这将直接关系到研究者的招募成效。
试验方案的制定应把握受试者需求,多方面考虑受试者:如知情同意书是否简单易懂,是否显示对受试者的尊重、访视频率是否会给受试者带来不便、是否有针对疗效较差受试者的应急治疗方案、是否有相应受试者的补助等。
4.1.2 合理选择研究机构
研究机构的质量直接关系到临床研究的成败,制定研究方案之时应当勾勒出合适的研究机构标准。主要从以下四个角度考虑:(1)外部环境:研究机构的地理位置不宜太偏远,不方便受试者的访视;(2)专业性:研究机构人员应对试验所针对的适应症有治疗和临床试验的经验,并有足够的人员保证试验的招募和筛选,且具备相当的教育或培训背景;(3)竞争性:研究机构或附近其他研究机构应没有竞争受试者的类似适应症临床试验;(4)内部环境:研究者应当对受试者有足够的耐心和诚意,态度良好尊重,同时应考虑研究者是否有充足的精力完成试验。
4.1.3 采取多样的招募措施
传统的招募主要依靠研究者或者其他医生的病人资源,此外也可以借助广告或网络等其他媒体宣传试验项目。在制定宣传计划之时,应当考虑到试验针对的人群,广告词应遵循GCP,明确参加试验的益处、参与时间、研究者信息等。
还可以考虑向被推荐和潜在受试者投递邀请函,在不违反GCP的前提下,对候选者表示欢迎,并介绍临床试验的意义和相应信息。鉴于目前公民医疗认识基础不高,建议给候选者提供疾病危害和临床试验意义的宣传材料,并相应提出建议,会增加候选者入组的可能。
4.2 采取受试者留置策略
4.2.1 研究者关怀
除受试者因为疗效或者不良反应退出试验或不可逆转的个人因素之外,大部分脱落是可以挽回的。研究人员对受试者的良好态度与耐心解答能够给受试者带来温暖而有效降低脱落率。研究机构应设法使受试者能在这里得到理解与支持,感到愉快并认识到参与试验的重要性。
研究者应尽量保证能与受试者有稳定的交流,能够增加受试者的信任,同时应尽量给受试者提供适宜的帮助,如可以定期电话提醒访视和关心病情、灵活调整访视时间避免工作冲突等。
4.2.2 申办者提供留置工具
申办者应辅助研究机构进行受试者留置,可以发展辅助受试者留置的工具:(1)在试验开展之初,可以发送欢迎信,并跟受试者家属进行通讯,简单介绍疾病以及研究的情况争取家属的理解与同意;(2)在例行体检之后,可以根据受试者的身体状况,提点一些日常应当注意的保健事项,条件允许下可制定保健计划,有利于受试者的长期保健;(3)试验开始之后,每次访视之后可以发放简单而温馨的访视预约卡或者访视日历,能贴在家里醒目位置最佳,从而起到提醒作用;(4)在访视候诊场所,可以提供免费的纸巾、热水和报纸或安排电视以提供舒适的环境;(5)定期可以给受试者一些价值特殊的纪念品,如杯子、手提袋等,在生日当天送张贴心的贺卡能够给受试者带来足够的温暖。无论是怎样的留置工具,为保证受试者的兴趣最为重要的仍旧是研究者对受试者的态度,研究人员的耐心与关心才是留置成功的关键。
4.3 提高受试者服药依从性
提高服药依从性主要从筛选受试者和劝导受试者两个方面进行:(1)在试验开始之前可以采用安慰剂导入期的形式或者数次预约门诊的形式,筛选出依从性较好的受试者;(2)研究者应当与受试者及家属有相应交流,能够加强其对药物和治疗过程的理解,并明确表明依从性的重要性及所带来的益处,并发动家属监督;(3)应给予定额、足够访视间期的药物,并充分说明如何用药,可做成便签贴在醒目位置;(4)明确告知受试者可能出现的不良反应,一旦出现不良反应应及时寻求研究者的帮助,报告不良反应并进行合理的治疗同时接受一定的补偿;(5)在受试者的常用病例上贴上参与试验的名称,以提醒其他医生避免开相互作用的药物;(6)最为重要的仍是研究者对受试者的关心与照顾,研究者友好的态度和耐心的解答,从受试者角度提出些日常注意事项等都会给受试者带来良好的印象,能够获得受试者信任,有助于依从性的提高。
参考文献
[1] 刘川.药物临床试验方法学[M].北京:化学工业出版社,2011.
[2]范大超.受试者有效招募及影响因素[J].中国处方药,2010,1(94):7071.
[3]卢根娣等.药物临床试验中受试者脱落的原因分析及处理[J].护理杂志,2008,25(10B):1719.
[4]汪秀琴,刘晓晓.临床研究的伦理审查:受试者退出研究的数据保留[J].中国医学伦理学,2012,25(5):575576.
[5]范大超.入组率的分析方法以及受试者的依从性[J].中国处方药,2010,3 (96):7071.
[6]胡咏梅,赵嘉芸,江济华等.某院药物临床试验受试者脱落原因浅析及对策探讨[J].安徽医学,2012,33(2):214216.
[7]范大超.评估及提高受试者依从性的方法[J].中国处方药,2010,4(97):7071.
关键词:药物临床试验;知情同意;依从性
知情同意(Informed Consent)指向受试者告知一项试验的各方面情况后,受试者自愿确认其同意参加该项临床试验的过程,须以签名和注明日期的知情同意书作为文件证明[1]。知情同意具体体现是知情同意书(Informed Form)的签订,知情同意书是每位受试者表示自愿参加某一试验证明。知情同意不是结果,而是获得受试者同意的过程[2]。依从性(compliance)是指患者执行医嘱的客观应答的程度。在新药临床试验中,依从性可定义为受试者按照规定的药物剂量和疗程服用试验药物的程度[3]。然而,有些研究者认为知情同意就是获得一张受试者签了字的文件。他们与受试者缺少沟通,受试者没有充分的时间考虑和提问,或干脆让受试者自己阅读,然后要求签字,使知情同意流于形式。殊不知,这一行为严重损害了受试者的权益,违背的GCP知情同意理念,同时也损害了受试者的依从性,并对试验的安全性及质量造成影响。本文就如何把握知情同意过程关健点,从而获得受试者良好依从性,谈谈自已作为研究者5年的临床工作体会。
1相互了解及沟通
知情同意过程是保障受试者合法权益的过程,但其同时也是研究者与受试者沟通交流的过程[4]。研究者在知情同意过程中合理的语言表达,良好的沟通技巧,可体现出研究者科学的试验态度及承担的责任感,能够使双方充分了解及信任,对提高受试者依从性有积极影响。有些受试者文化素质较高或多疑的患者,时常会提出有关试验的种种疑惑,研究者需耐心解答。充分了解及沟通是知情同意的基础,也是保证依从性的重要法宝,可以说没良好沟通,就没有试验的顺利进行。而临床医生在进行临床试验中,同时承担着繁重的医疗工作,研究者需协调好二者的时间关系,与受试者充分沟通,为试验入组后的顺利进行提供保障。这一点重要性许多研究者并未认识到, 仓促入组受试者,导致后续工作问题不断,无谓脱落,同时也对试验的安全性及质量造成影响。
2受试者充分知情
知情同意需遵守"充分告知,完全理解,自主选择"的基本原则[5]。研究者需用受试者能理解的方式(口头或书面),完成受试者充分知情,需让不同文化层次的受试者完全理解研究者所讲述的内容。有阅读能力者,在知情同意过程,需一并发给知情同意书,让其详细阅读。理解能力差或无阅读能力的受试者需有亲属一同阅读及知情。在知情过程中,需让受试者有充分的时间提问,以达到充分知情的目的。只有充分理解信息,才能使受试者及家属做出是否参加试验的决定,受试者的意愿才是真实的。通过充分理解信息,既保障受试者应有权益(知情权及决定权),同时又促使受试者表现出良好的依从性。
受试者要服用免费的药物,那么其药物来源情况(厂家、国产或进口药物)、药物作用机制及可能出现副作用等情况,也是受试者需知情的。药物本身因素对受试者依从性存在潜在影响。我内分泌专业进行的降糖药物DPP-4酶抑制剂及钠葡萄糖转运体-2抑制剂,因其为国外药物,且独特降糖机理,副作用小,使不少受试者表现出相当的兴趣,受试者在试验中表现出良好的依从性,承担的3项国际多中心项目均无脱落病例。研究者在这个过程需对临床试验药物情况做详细的介绍,消除受试者的疑虑,这一过程保障了受试者的知情权,同时提高了患者的依从性。但需明确,受试者在试验中可能被分在不同的组别,服用不同的药物,这是双盲试验所要求的,受试者无权选择服用哪个组别的药物,这需受试者予以明白与理解。
研究者在知情同意过程中,需将试验的整个过程明确给受试者(试验需回访次数、回访时间、访视窗、抽血留尿化验情况及整个试验的期限等)。这一知情,能使受试者对试验整个过程做到心中有数,是否能按时回访,从而进一步签属知情同意书。一些研究者由于种种原因,忽略了上述内容的知情,导致一些受试者因无法按时回访而退出试验,增加了无谓的脱落。
3受试者的权益与义务
知情同意权是药物试验中受试者享有的核心权益,包括对试验相关信息详细获悉的权利(知情权),及自主选择的权利(自主决定权),它使受试者人格尊严得以实现[6]。知情权应有持续性,研究者应及时将和试验项目有关的最新的医疗信息传递给受试者,让受试者自行决定是否继续参与试验。试验中一些检查化验结果回报后需及时告知受试者。受试者完全自愿参加临床试验而不被胁迫或诱导,并有充分的时间认真考虑;受试者有权在试验的任何阶段随时退出试验,而不会遭到歧视和报复,其医疗待遇与权益不会受到影响。受试者的权益、安全和健康必须高于对科学和社会利益的考虑。在整个试验过程中,研究者应维护受试者应有的权益。受试者享有权益的同时应履行配合义务。知情同意过程中应同时对受试者及其家属进行应尽义务与依从性相关性教育,使其明确参加试验应尽的义务,严格按照医嘱执行治疗及检查,并定期回访,否则将被退出试验。受试者权益与义务的明确,对受试者依从性有重要影响。
受试者隐私权是绝对需保护的,隐私权也是伦理委员会审查要点[7-8]。明确告知受试者根据《赫尔辛基宣言》及《药物临床试验质量管理规范》原则,会尽可能采取措施确保受试者的隐私权,保证参加试验的个人资料不会对外泄露且均属保密。这一知情,可解除部分受试者对隐私外露担心,提高其依从性。
4受益、风险、医疗、保险及赔偿
临床试验受益与风险是并存的。研究者需客观的解释受益情况与可能出现的风险,不宜过分夸大受益,也不要突出风险。一些受试者对"试验"感到恐惧,需多做解释,使其理解受益与风险的并存性。如受益因素首先包括免费的药物治疗、血糖监测、全面的体格检查。此外,参加过药物临床试验的受试者,在以后糖尿病的咨询、诊治、开药及住院治疗等方面均具有优先权;参加过临床试验的受试者,也优先再次参加其它试验。此外血糖仪赠送,回访交通补助,不良反应治疗费用报销等均对受试者的依从性有较大影响。但这些受益因素应适当,不宜过度诱导受试者,以免失去依从性的真实性。有些研究者过分夸大受益因素,当入组试验后,受试者出现较大心理落差时,便可能成为脱落的病例。
不良事件及不良反应是药物临床试验中不可避免的,这也是试验的风险所在。当出现上述情况时,研究者应及时医疗救治,这是《指南》和《规范》对药物临床试验的基本要求,也是保障受试者生命健康权的体现。研究者首先应在知情阶段对受试者介绍药物可能出现的不良反应,使其思想上做出准备,并告知受试者,在出现不良反应时,应尽快联系医生,以便尽早处理。有些不良反应,可暂时观察,继续服药。比如降糖药物二甲双胍和阿卡波糖,可能开始服用后出现胃肠道不适,但多可耐受,无需停药,必要时合并一些治疗药物,无需中止试验。但一些不良事件及不良反应需立即中止试验,并及时处理及上报。在整个处理过程中,研究者应负有责任感,及时准确处理不良医学事件,与受试者多沟通,减少其对不良反应过度担心,从而可以提高依从性,减少不必要的脱落。
《指南》规定:受试者因参加研究而受到伤害,研究者应保证其有权获得对这类伤害的免费医疗,以及经济补偿,作为对造成损害、残疾或者障碍的公正赔偿。在知情过程中,研究者需对受试者就保险、赔偿与治疗情况向受试者说明。在临床试验过程中如有发生与临床试验相关的损害时,受试者将得到进一步的医疗救治和合理赔偿。这样才能使受试者的经济补偿权得以保障。因目前国内尚无完善的保险及赔偿机制,要加强对受试者补偿权的保障应当首先在立法层面多做工作[9]。经济补偿权的保障,将会带来更好的受试者依从性。
参考文献:
[1]国家食品药品监督管理局.药物临床试验伦理审查工作指导原则[S]2010.
[2]杜彦萍,杨忠奇,汪朝晖.对药物临床试验知情同意的解析[J].中医药管理杂志,2011,19(07):623-624.
[3]卢根娣,张鹭鹭.药物临床试验中受试者的依从性管理[J].医院管理杂志,2008,15(03):293-295.
[4]王晓翔,石军梅.药物临床试验中研究护士与受试者的沟通技巧[J].河北医药,2013,35(01):151-152.
[5]张弛,刘利军,翟晓梅.药物临床试验中受试者权益保护存在的问题及对策[J].中国医学伦理学,2012,25(02):148-150.
[6]杨慧艳.维护受试者在药物临床试验中的知情同意权[J].中国临床药理学杂志,2011,27(11):886-887.
[7]顾加栋,姜柏生.论药物临床试验受试者的权益保护[J].中国卫生质量管理,2010,17(02)57-59.
药物临床试验的意义及弊害
从医学发展史看,没有药物临床试验就没有医学。虽然人类攻克了一个又一个医学难题,但当面临新的疾病谱,或为提高诊断技能和生命质量而采取新药物时,必须经过药物临床试验来确定药物是否有效、安全及不良反应大小,能否在临床中应用和推广。药物临床试验的收益体现在三个方面:①受试者本人可能是直接受惠者;②对医学事业的发展有促进作用;③给社会带来健康福音2。但药物临床试验也具有风险性,这种风险既有躯体上的风险,也有心理上、社会适应性上的或是经济受损的风险。因此,药物临床试验既要考虑医学的收益性,也要考虑其伦理规范。凡是得明显大于失的,具有较大医德价值的实验,可以实施;而得明显小于失的或得失不明显的,如科学依据不足、后果不确定等,则不应该实施。
药物临床试验的伦理聚焦
药物临床试验综合评价过程的伦理问题:药物临床试验中存在复杂的伦理问题,在实施中,人们往往关注结果或效果,忽视伦理学评价或缺乏综合评价过程。一般来说,综合评价过程需要从实验的对象、实验者的动机、实验的方法和实验的结果四个方面进行综合评价3。⑴试验对象的伦理问题:临床试验对象包括各类不同病症的患者和正常人。药物临床试验必须保护、尊重和促进人的生命价值和尊严,要强调对受试者的利益和尊严负责,最重要的是取得受试者的知情同意和自由选择,避免任何形式的诱导、欺骗和强迫。尽管每一个人都有促进医学和健康的责任和义务,但也要让受试者充分了解所参与的药物临床试验的意义、目的及危险性,本着自愿参加原则,才是符合伦理规则的。⑵药物临床试验动机的伦理问题:药物临床试验存在社会公益和患者利益间的矛盾4。以社会公益为目的的试验动机,符合科研道德,但却具有内在性特点,不易判断,如是否隐含追求名利,或存在对受试者造成伤害,这就要求护理人员有高度的伦理学认识,要充分考虑受试者的现实利益和治疗意义,其次才考虑医学知识的进展和积累。⑶药物临床试验方法和结果的伦理问题:护理人员也常被认为是受试者的信托人5。试验方法和结果是否对受试者和实验操作者存在欺骗,是否给受试者带来肉体、尊严和精神上的伤害,护理人员在试验过程中都应有所分析。《赫尔辛基宣言》提出了临床实验需要遵循的最基本的4条原则:①参试者的人和尊严必须得到尊重和保护;②研究过程必须完整,临床试验必须在临床前期试验的基础上进行,其本身必须是科学、可行的;③必须将临床实验的有关事宜通告受试者;④只有受过训练及有经验的临床研究人员,才有资格从事临床试验工作6。对于安慰剂问题,从伦理学原则上要求安慰剂对照要被严格限制在病情比较稳定,在相当时间内不会发生危险和带来不良后果,也不致延误治疗时机的患者;危重患者、病情发展变化快的患者不宜使用安慰剂。双盲实验要求受试者确诊后症状不严重,暂停治疗不致使疾病恶化或错过治疗机会,受试者要求中断或停用实验时立即停止实验7。
知情同意中的伦理问题:知情同意是一个完整的概念,包含两层含义,即知情权和同意权,知情是同意或拒绝的前提,同意是知情的结果。早期伦理法典《纽伦堡法典》规定的伦理规范中,第1条即要求知情同意,1964年《赫尔辛基宣言》对知情同意进一步补充,如:①如某一新的治疗方法有挽救生命、恢复健康或减轻痛苦的作用,应首先采用,但采用前,应向患者解释清楚,征得患者同意。对无行为能力者,必须事先取得法定人的同意。②须向受试者说明此研究的性质、目的和危险性。③患者未完全知情及同意之前,不可对其实施临床研究。④受试者的同意应以书面为凭8。
护理人员伦理规范对药物临床试验的促进
1998年我国颁布了《药品临床试验管理规范(实行)》(GCP),对药品临床试验进行规范化管理。同年成立了“卫生部涉及人体生物医学研究伦理审查委员会”,制定了《卫生部涉及人体的生物医学研究伦理审查办法》,这些都是医学界从事人体实验研究的道德守则,不是法律,不具有约束性,因此,提高护理人员道德修养和自律是保证药物临床试验顺利进行的重要条件和前提。
药物临床试验基地是国家批准的,这些基地相对比较了解有关规定,运作比较规范,但护理人员也存在对临床试验知之甚少,却又经常有机会接触或参与临床试验,这是非常危险的。药物临床试验中的伦理规范应逐渐被护理人员认识和遵守,在试验过程中要考虑伦理问题,在发展和促进过程中使药物临床试验更符合规范。
参考文献
1 张文静.药物临床试验质量控制及相关因素研究[D].山东大学,2011.
2 马家忠,张晨,王雷,等.护理伦理学[M].北京:中国中医药出版社,2005:157—160.
3 王国平,胡曲.关于人体实验的伦理评价与原则选择[J].中国医学伦理学,2003,16(2):15—16.
4 冯显威,刘俊荣,安丰生,等.人文社会医学导论[M].郑州:河南医科大学出版社,2000:267.
5 孙忻.临床科学试验中的伦理学思考[J].中华医学科研管理杂志,2006,19(1):17—18.
6 Wills C,Tyeku munity is essential in clinical trials[J].BMJ,2000,321:833.
GCP第二章第七条规定:“所有研究者都应具备承担该项临床试验的专业特长、资格和能力,并经过培训。”第七章第四十六条规定:“监查员应有适当的医学、药学或相关专业学历,并经过必要的训练,熟悉药品管理有关法规。”《药物临床试验机构资格认定办法(试行)》的附件2《药物临床试验机构资格认定标准》规定:“组织管理机构负责人、药物临床试验机构办公室主任及秘书、Ⅰ期临床试验研究室负责人及研究人员、药物临床试验专业负责人及专业研究人员都要经过临床试验技术和GCP培训”,同时规定要建立人员培训制度。《药物临床试验机构管理指导原则(征求意见稿)》第五章规定:“明确药物临床试验机构应制定培训的标准操作规程,包括年度培训计划、培训内容和培训记录等,定期对药物临床试验的所有相关人员进行培训和考核。培训内容包括药物临床试验相关法律法规、临床试验技术以及相关的管理制度与标准操作规程,培训方式可以包括专业进修、培训班、研讨会、网络培训等。”总之,与药物临床试验相关的法规都明确规定了与药物临床试验相关人员要经过药物临床试验技术与法规的培训、药物临床试验机构要建立人员培训制度的要求。
2临床试验培训的现状与存在的问题
与临床试验相关的研究者、研究护士、机构管理人员、监查员、统计人员等的专业背景涉及到临床医学、药学、护理学、统计学等多个学科,然而当前没有任何一个学科将临床试验纳入到教育体系。调查显示,我国临床医师对临床试验的认知水平较低,基本上未获系统培训,培训缺乏规范性和系统性。以我院为例,目前我院研究者和临床试验管理人员参加临床试验培训的模式主要有外出参加GCP培训班、临床试验专题培训班、GCP网络培训、医院内部的临床试验知识与技能培训、与临床试验项目相关的会议如方案讨论会等。在开展工作的过程中,笔者也发现各种培训模式均存在着种种问题。
2.1临床试验培训的模式
2.1.1以取得GCP证书为目的的培训。GCP培训的组织情况以及药物临床试验机构人员对临床试验知识的掌握是药物临床试验机构资格认定现场考核的重要内容。按照《药物临床试验机构资格认定办法(试行)》的规定,要建立培训制度,组织进行GCP培训。骨干人员如机构管理人员、专业负责人等要参加国家级的培训机构组织的培训班并获得培训证书,培训形式可以是现场培训班或者网络培训。其他相关人员可以参加由药物临床试验机构组织的院内培训。因此,在进行药物临床试验机构资格认定或复核之前,药物临床试验机构会大批组织人员参加GCP培训,并取得GCP培训证书。
2.1.2临床试验项目运行过程中的培训。临床试验项目运行过程中进行的培训包括GCP培训、试验方案设计讨论会、临床试验启动会、专项临床试验技术研讨会与培训班等。首先,与临床试验相关的研究者和监查员要经过GCP培训并获得证书;其次,药物临床试验机构要进行药物临床试验机构制度与标准操作规程的培训;第三,主要研究者或研究骨干参加试验方案设计讨论会、阶段总结会与总结会等,全体临床试验有关人员参加临床试验启动会,会议内容以临床试验方案为主同时涉及相关临床试验知识与GCP的内容。
2.2现有模式存在的问题
2.2.1以取证为目的的培训与临床试验工作需求有落差。我院药物临床试验相关人员多数在接收药物临床试验机构资格认定检查之前没有接触或规范地开展过药物临床试验,对临床试验没有直观认识,在反复多次接受GCP培训后,普遍感觉培训内容枯燥繁杂,好多内容需要“死记硬背”。最后导致大部分人现场检查中虽能够流利地回答出检查专家提出的有关GCP基本知识的问题,但是对有关临床试验运行管理流程以及试验方案设计等方面的问题不能顺利地答复。对于资格认定标准要求制订的制度和标准操作规程(SOP),多数按照其他现有的模式照搬,从制定人到执行人都不能深刻理解其内涵,很难做到“写所做的,做所写的”。参加网络培训的人员,组织机构缺少监督监管机制,基本上是报名后都能取得培训证书。
2.2.2研究者对临床试验进行过程中的培训不够重视。部分科室在取得药物临床试验机构资格之前开展过临床试验,但是科室研究者对临床试验进行过程中的培训不够重视,主要存在以下两方面的问题。首先,研究者不能充分认识组织各种临床试验会议的意义。由于试验方案讨论会多由申办者在中心城市组织进行,所以有研究者将参加该类会议当成福利,甚至会安排与临床试验无关的人员参加。其次,药物临床试验启动会流于形式。启动会的培训材料多由申办方准备,部分主要研究者不考虑启动会培训内容,甚至要求尽量压缩启动会培训时间,且不能保证参加临床试验的研究者及相关人员参加会议。所以监查员只是简单讲解一下试验用药品和试验方案的入选、排除标准,其主要精力和时间多用于收集各种试验表格的研究者的签字,使启动会流于形式。
2.2.3申办者或合同研究组织(CRO)和监查员的水平参差不齐。为保证研究者按照试验方案和GCP的规定开展药物临床试验,申办者或CRO应该组织药物临床试验机构与临床试验相关的所有人员进行培训,培训内容包括试验方案、临床试验的实施流程及注意事项、GCP相关知识等。CRO和监查员的水平差别很大,专业技术水平较差的监查员不仅很难保证临床试验质量,而且甚至会对研究者进行误导。如知名的跨国CRO昆泰(Quintiles)和科文斯(Covance)具备高水平的专业技术团队和国际操作标准,对临床试验整个过程的各个环节有严格规范的标准,监查员会结合临床试验的进展情况对研究者进行不同形式的培训,对于提高研究者的临床试验水平、规范研究者的行为能发挥积极作用。中国本土的CRO水平差异较大,由于没有CRO准入制度,很多CRO的规模较小、水平偏低。而制药企业的医学部或者临床部多数不是该企业的重点部门,人员不够充足,制度不够健全,组织开展临床试验的水平也较低。甚至有企业的监查员不能理解和掌握试验方案,在开项目启动会时不能讲解明白试验方案的内容。另外,大部分监查员都会同时管理多个临床试验项目,工作强度很大,如果机构没有特别的规定,多数监查员在保证申办者基本要求的情况下也会尽力减少自身的工作。
3对策建议
3.1结合临床试验需求组织培训在准备申请药物临床试验机构资格认定之前,医院成立临床试验管理部门,按照GCP要求开展药品上市后临床试验。临床试验管理部门制订培训计划、设计培训内容,结合临床试验对组织研究者进行GCP培训。我院药物临床试验机构每年制订培训计划,对各专业结合项目开展情况分别组织培训,分别由机构办公室工作人员讲解药物临床试验基础知识、药物临床试验机构运行管理流程及注意事项、药品管理及资料档案管理等内容,由专业研究骨干讲解专业药物临床试验控制、专业人员职责等内容;逐步培养建立临床试验团队,积累临床试验经验,为申请药物临床试验资格认定做准备,避免在接收药物临床试验资格认定现场检查时发生机构人员经验不足、对临床试验认识不够深入等问题。
3.2在临床试验运行过程中加强管理和监督首先,加大对研究者资格审核力度,要持证上岗,杜绝未经过任何培训的研究人员进行临床试验相关活动;确保临床试验项目组成员经过GCP培训,熟悉临床试验制度和流程。机构或专业组在临床试验启动前对项目组成员进行培训,明确临床试验相关人员职责,讲解临床试验流程,强调在临床试验进行过程中需要注意的问题。在临床试验进行过程中及时对出现的问题进行归纳整理,对研究者有针对性地进行反馈和培训。选派研究骨干外出参加临床试验专项培训。其次,督促主要研究者亲自或安排项目骨干研究者参加试验方案设计讨论会,确保研究者从试验开始时即熟悉试验方案的主要内容。第三,督促主要研究者组织召开临床试验启动会并确保临床试验相关人员参会,机构人员审核启动会培训资料并派代表参加会议,保证启动会的效果。第四,培训工作要注意方式,要从简单地灌输一些临床试验法规(如GCP、《药品注册管理办法》等)转变为如何在实际工作中实施这些法规,增加临床试验工作要点和难点的讨论与交流;在临床试验进行过程中针对人员职责制定不同的培训教材,分别进行培训。如组织科室药品管理员进行试验用药品管理的培训,组织专业质控人员进行质控制度与SOP的制定与学习。
3.3加强监查员管理将“监查员获得GCP证书”作为其独立完成临床试验监查工作的准入资格;药物临床试验机构将对监查员的审核纳入项目审核标准,制定监查员工作指南,规范其在机构的行为;机构办公室对监查员组织的培训资料进行审核。
4结语
【关键词】 医院药物经济学
药物经济学是近年发展起来的一门新的边缘学科,在优化治疗方案,指导临床合理用药,节省卫生资源方面起到了重要作用,其基本理论和基本概念已为广大的药物经济学研究人员所熟悉,各医疗单位广泛开展了药物经济学的实际研究。药物经济学研究目的是使药物在临床治疗中,不仅要考虑药物的安全性和有效性,同时也要考虑经济因素,使患者以最小的经济负担得到最佳的治疗效果,以期为临床合理用药提供参考依据[1]。其研究结果应能反映临床实际情况,这就要求研究人员在进行药物经济学研究时,必须从实际出发设计研究方法。
目前药物经济学主要采用三种研究方法:一是随机临床试验(简称RCT) ;二是观察性研究;三是实际临床试验(简称PCT)。为了便于对这三种方法进行比较分析,应明确对药物经济学中常用的统计分析方法之一的成本效果分析[2]方法中的效果与功效的两个概念区别。一般认为效果是在药物的临床实际使用的条件(即自然状态下)特定人群中患有特定疾病的个体接受药物治疗以后可能获得的效益;而功效是在药物理想使用条件,特定人群中患有特定疾病的个体,接受药物治疗后可能获得的效益。从定义中可以看出药物经济学所需要的是效果,更能反映临床实际情况。
1 随机临床试验
随机临床试验以某个时间为起点向前进行研究,要求所有试验对象均随机分配到试验组合对照组,按照试验设计的要求对个体进行药物治疗、检查。在随机临床试验中,不论是试验组还是对照组,研究个体除了所使用的药物不同外,其他应相同(包括所作的各种检查、其他治疗手段等),临床医生不能随意修改治疗方案,如给药剂量、给药次数等。随机临床试验有三大优点:一是均衡,试验对象随机分配到各组,消除了分配偏倚;二是便于组间比较,因为随机化消除了设计中未直接考虑而在试验中存在的干扰因素可能产生的偏倚;三是能有效的 对各组间进行统计的显著性检验。缺点是研究经费较高、费时。前瞻性随机临床试验是研究药物功效的一种方法,用于评价新药的功效确实不失为目前最好的方法,但由于其可能存在过高估计药物治疗成本,从而掩盖研究药物与对照药物之间原本存在的成本差异的缺陷,因而在用于评价药物的经济学效果是并不是最理想的方法。
2 观察性研究
观察性研究是基于回顾性数据的一种研究方法,它主要用于评价药物的经济学效果,实际操作时按照研究设计的要求,以某个时间点为研究的终点,收集过去某个时间范围内满足研究要求的所有病例作为研究对象。该法的主要优点是研究结果反映的是临床实际情况,同时省钱、费时少。缺点是存在分配偏倚,造成研究组和对照组并人间的基本特征不一致,进而影响研究结果的准确性。对于样本数足够大的研究,可以采用分层或配对的方法来小除非随机分组所带来的研究组和对照组之间的不一致,即偏倚。
3 实际临床试验
实验临床试验与随机临床试验一样,以某个时间点为起点向前进行研究,将所有试验对象随机分配到试验组和对照组;不同的是它不要求对研究组和对照组作相同的检 查或采用其他相同的治疗手段等,它允许临床医生根据自己的临床经验修改治疗方案,如改变药物的用药量、用药次数等。实际临床试验除了拥有随机临床试验的三大优点外,它还反映了临床药物使用的实际情况,缺点是研究经费高、费时。实际临床试验主要用于评价药物的效果。
4 讨论
RCT因其能有效消除药物经济学研究中旬在的偏倚,目前是药物经济学研究中用的最多的一种方法,有人甚至把它看作使药物经济学研究中的金标准,但从功效和效果及药物经济学应用于实践的特性的角度来看,只是基于药物效果而不是药物功效的药物经济学评价才更有用,更能为广大医药工作者所接受。采用随机临床试验的方法获得的药物经济学结果属于功效研究,只能看做是成本功效分析,不能被认为是成本效果分析;另外它可能会过高估计药物治疗的成本,不能反映真实世界(real would)(临床实际)里的成本情况。PCT是一种在真实世界下评估药物效果的一种方法,与RCT相比有了大的进步,是一种比较好的药物经济学研究方法,但由于其拥有与RCT某些相同的缺点,如费时、费钱、样本数偏少及随访期短等,目前该法用的并不多,远远少于RCT。相比之 下,基于回顾性数据的观察性研究倒不失为进行药物经济学研究的一个行之有效的方法,由于观察性研究省钱,费时少,只要拥有适当的样本数和和足够的统计能力(statistic power),就能确保样本的代表性和研究对象间的一致性。
本研究对药物经济学研究常用的三种方法进行了比较,比较其优缺点,各研究者可根据研究的实际情况选择自己认为合适的研究方法。当然,药物经济学的研究方法并不限于以上三种方法,我们还可以运用其他的方法,如模型模拟的方法等。可以预见,在未来的几年,药物经济学研究将在控制药品费用中起到十分重要的作用。
参考文献
【关键词】 创新药;临床试验;实验数据;质量控制
文章编号:1004-7484(2013)-10-5904-01
创新药的研究有两个显著的特点,那就是渐进性和不确定性。创新药的研发是一项系统的工程,需要长远考虑到产品研发的前期、中期和后期,以及产品的上市。药学研究的深度和广度是不可预见,但是各阶段的研究目的是明确的,审评重点要有侧重。各阶段的研究数据要做好详实记录,为以后各阶段的相关性研究和产品质量控制做好基础。在创新药研究的各个阶段都有要注意的问题和审评的重点。
1 创新药不同研发阶段评价核心
创新药研发的I期是临床申请,这一阶段的核心是药理毒理的评价。这一阶段并不需要提供完整的药学研究信息,重点是研究安全性相关的问题,其中包括杂质、稳定性和无菌剂等等。在I期临床试验阶段,药物的剂型、规格、处方、工艺等都是不确定,生产批次也是有限。受试者需要在严格的监护下用药,通常受试者的数量不会太多,暴露出来的问题也是短暂的,这些原因导致不能进行完整的药学信息分析。如果在I期临床申请中安全性问题不能确定,或者数据不足以进行安全评估,那么I期临床申请将被暂缓,通常的原因是产品杂质特征明显具有毒性和潜在毒性,或者是不能完全确定杂质的毒性。I期临床申请完成后,二Ⅲ期临床申请的主要工作是临床专业评估。这阶段药学审评的重点依然是安全性相关的问题,不过这阶段重点是关注持续性更新与安全性相关的杂质、稳定性等方面的数据,重点监控可能影响安全性的各类变更。创新药研发阶段会有很多变更,这是尝试新药的必经之路,变更包括生产工艺、规格、剂型、质量分析等等,任何一项变更都可能影响到新药的安全性,因此这阶段将安全性相关问题与持续变更作为审评重点。
2 创新药各研发阶段的药学研究信息
创新药的研究是一项系统工程,具有一定的不可预见性,研究的深度和广度都是随着研究的进程不断延伸的,很多情况是不能预知的,各个阶段提交的药学信息也是在逐渐增加,可以参考FDA和EMEA的原则,创新药研究过程中各阶段提交的信息量主要与以下的因素有关,包括临床研究阶段、临床试验类型、临床试验时间、受试者因素、疾病的性质、给药途径以及剂量,此外还有暴露出的风险、潜在风险、产品性质、特殊药剂等等。这些因素都可能造成药学信息的变更,对创新药下阶段的研究至关重要。通常创新药的早期临床都是原料填充胶囊,或者原料药混悬液填充胶囊,一般不会选择特殊剂型和一些复杂生产工艺。
3 药学研究试验数据的记录和保存
对于创新药的研究,完整和详细的数据对于各阶段的相关性研究有着重要作用。临床研究样品的杂质水平不能超过动物安全性实验数据提供的杂质水平,临床前动物试验和临床试验应该有一定的可比性,尤其是在药物质量方面。如果早期的临床试验的处方、剂型等发生变更,研究者需要将后续的临床试验数据与早期的临床试验进行对比性研究,对临床试验进行风险评估。新药在上市时需要有完整的质量控制体系,而研究阶段的数据将作为质量控制的重要依据。创新药的质量控制体系都是依据原始数据建立的,比如临床前安全性试验样品数据、药代动力学试验样品数据以及各阶段临床试验样品数据(包括杂质水平、剂型、制备工艺、溶出行为等)等等。因此,在创新药研究的过程中一定要做好数据的记录和保存,详实的记录为以后产品上市打下坚实基础,尤其注意关键数据的记录和积累,例如分析报告、批次生产记录和图谱等等。
4 临床试验用药物制备的要求
现行《药品注册管理办法》第三十五条规定:临床试验用药物应当在符合《药品生产质量管理规范》的车间制备。I期临床研究开始将药物用于人体试验,执行《药品生产质量管理规范》有助于保证受试者的安全。在早期临床试验阶段,可能只需要制备一个批次的药物制剂,且可能仅需要小规模样品,早期(尤其是I期)临床试验样品制备具有其特殊性。2008年7月FDA了《I期临床试验用样品的生产质量管理规范》,详细阐述了I期临床试验样品生产落实CGMP的问题,建议采用药物质量控制(QC)原则作为CGMP的一部分保证I期临床试验样品的质量和安全性。质量控制原则的主要内容包括:确定的书面操作规程;适当的设备和生产环境:有关生产(包括检测)准确一致的记录数据。该指导原则对确定I期临床试验样品的生产环境给出了详细建议,详细阐述了I期临床试验用样品推荐的CGMP要求,对国内创新药早期临床试验样品的制备有较好的参考意义。
5 Ⅲ期关键性临床试验样品
Ⅲ期关键性临床试验结果是支持NDA申请安全性和有效性的重要内容,Ⅲ期关键性临床试验样品质量控制信息也是NDA申请的药学审评的关注重点之一。为了在今后能够生产出与Ⅲ期临床试验样品一致的产品,NDA申请的质量控制研究需要各种质量控制的信息,包括临床前和临床安全性、有效性研究数据等等,特别是Ⅲ期关键性临床试验样品的质量控制数据。一定要注意样品数据记录的完整和详实,要把样品的制备工艺、工艺控制、处方以及体内吸收等数据完整记录保存,除了实验数据外,与疗效相关的理化性质和生产批次也是记录的重点。Ⅲ期是关键的临床试验,其周期往往很长,受试者的数量较多,创新药的样品批次较多,这些都是需要注意的问题。
6 小 结
综上所述,创新药的研发有着一定的特点和规律,创新药研发过程中,药学研究的深度和广度都是在不断延伸的,各个研究阶段的研究重点不同,但相互之间又有关联。药学审评是创新药研究过程的重点,需要考虑到研究的渐进性和不确定性,建立科学合理的审评机制。同时要做好各阶段研究数据的记录和保存,这些数据为各阶段的相关性研究提供依据,也为产品上市后的质量控制体系提供数据支持。
参考文献
1 药物临床试验中存在的问题
临床试验展示了中医药对人类疾病具有良好的疗效,如中药治疗湿疹、青蒿治疗疟疾以及砒霜治疗白血病[2 -4]。中医药的临床研究中还存在诸多问题[5],不及时解决会制约中医药的快速发展,影响中医药的疗效评价以及国际认可度。列举如下: ( 1) 大规模、多中心或随机双盲安慰剂对照试验极少; ( 2) “随机”概念的误用或滥用,中药试验的对照设置不合理,如中药与中药比较的临床试验; ( 3) 存在发表偏倚和系统误差使结果不可靠,疗效评价指标选择不当,疗效评价未能体现中医特色; ( 4) 临床试验报告不规范,未按照CONSORT 报告标准; ( 5) 尚未建立达到国际标准的临床试验机构和评价机构,缺乏对现有临床研究证据的研究综合。这些问题导致中医药高级别的临床证据严重匮乏,以至于有学者感叹“再不做中医药临床疗效的系统评价了”。( 6) 绝大多数的中医药 RCT 发表于我国的中文学术期刊,鲜为西方医学界所知,其有关的疗效结果很难在国际临床医学领域交流; ( 7) 由于语言条件的限制、由于循证医学的模式及其方法技术刚被引入我国,因而针对这些中医药 RCT 而制作的系统评价更是凤毛麟角,限制了西方医务工作者对中医药安全、价廉、简便特点的认识。因为其结论总包含“我们还需要设计优良、大样本多中心的临床研究[6 -8]”。
2 大样本多中心临床试验的必要性和可行性
大样本随机临床试验是评估某些治疗措施的最佳方法,尤其适用于上市药品后的再评估,是循证医学 (求证医学) 的良好实践[9]。大样本多中心随机对照临床试验是药品上市后疗效再评价的最佳方法,可公正地评估药品的长期疗效和安全性,评估药物治疗对患者生存状况及并发症的影响,并可产生巨大的社会效益和经济效益。
3 大样本临床试验的管理与质量控制
大型临床试验一般是由医疗科研人员发起,为解决医学领域某些尚待解决的重要问题进行的临床研究,主要目的是评估某种防治措施对患者生存率及重要临件的影响[10]。大型临床试验所涉及的分中心多,研究时间长,样本量大,在实施前、实施过程中,数据管理和质量控制方面的任何问题都会影响试验的质量和结果的真实性,因此必须有一套合理的科学管理和质量控制规范,才能保证研究质量。
3. 1 构建三级质控体系是进行质量控制的重要手段
本课题建立了由项目负责人、试验专业负责人、机构专家组共同构成的三级质控体系。在每个项目组内设 1 名专业质控员进行临床试验的“一级质控”,专业质控员一般是项目负责人。专业质控员在本试验专业负责人的指导下,认真把好药物临床试验质量第一关。试验专业负责人一般是科主任,由科主任对临床试验过程进行“二级质控”,更有利于监管工作的顺利进行。机构办公室聘请专职和/或兼职专家组,对所有在研项目实施“三级质控”,负责每月组织对所有在研项目进行定期或不定期检查,以及对在研项目进行结题前的终末质量检查。正因为有如此众多的质控人员的参与,方能保证高质量地完成临床试验。
3. 2 建设过硬的研究团队
上市药品的大样本多中心临床试验与新药临床试验不同,研究者培训由课题领导小组统一负责,由于协作单位多、观察周期长、方法学要求高、主要评价终点事件的发生情况,方案实施起来难度较大,而且协作单位并非都是国家批准的药品临床试验研究基地,因此必须采取有针对性的措施,进行有效的研究者培训,保证多中心临床试验遵循 GCP 和试验方案的要求实施。评估成绩好的课题有多方面因素,建设过硬的研究团队必不可少。课题负责人及相关领导对课题研究高度重视,多指派专人管理研究药品、专人负责研究过程,如病例的纳入、检查等,研究人员全部经过培训,相互配合,在繁忙的临床工作中做好课题研究。团队创新意识较强,积极进行临床试验国际网站注册,并注意及时总结、; 研究基础好,方案设计比较成熟,优化方案阶段未占用过多的时间,也是实验顺利实施的保障因素。
3. 3 重视课题中期培训
知情同意书、病例报告表、药物发放回收记录表这些关键表格是整个试验的主要数据来源,表格的填写情况也从侧面反映了研究者的依从性、受试者的依从性、试验数据的真实性等方面的问题。查看研究者是否如实、详尽、及时、完整、准确地填写了各项表格,是监查工作的重点内容,规范化地填写研究表格则是平时研究工作的重点[11]。针对病例报告表填写和修改不规范的问题,首先应强调研究人员在填写时要仔细、认真。应对研究人员进行中期培训,强化对研究方案和操作标准的掌握,减少笔误。确保作为诊断和疗效评价工具的量表评定的一致性、证候诊断准确性,对检测的方法也要进行评价,以保证研究数据的真实、准确。通过培训还可以交流经验,进一步掌握纳入标准,提高患者依从性,降低脱落率。分中心的质量控制也应加强,课题组要到分中心进行巡察。
3. 4 加强研究过程管理
3. 4. 1 保证病例报告表( CRF) 的质量 由于研究者的背景、临床操作能力、工作的严谨程度及测量偏差等因素的影响,都会给最终的结果带来偏倚,因此进行研究者的培训,培养试验的责任心,把握好较易出错的环节就显得颇为重要。在进行 CRF 表填写之前详细了解填写说明,用正确的方法将所涉及道德任何试验数据、结果、检查都要详细、如实记录在原始的 CRF 表中,完成填写后要自我检查,这样可以进来避免纰漏,如有修改要签名填写修改时间。此外,CRF 表应完整记录受试者的治疗过程,包括合并用药的情况、出现不良事件的情况等。应详细询问,跟踪观察。要注意有其他疾病的患者合并用药的问题以及有肝功能、肾功能等实验室检查异常者的随访,以确定是否是药物不良反应,不良反应要如实记录。
3. 4. 2 充分调动监查员的积极性 临床监察员的工作最核心的是去各家医院检查项目的执行情况,具体包括: ( 1) 确认所有不良事件均记录在案,严重不良事件在规定时间内作出报告并记录在案; ( 2) 试验用药品按照有关法规进行供应、储藏、分发、收回,并做相应的记录; ( 3) 协助研究者进行必要的通知及申请事宜;( 4) 监查并如实记录研究者未能做到的随访、未进行的试验、未做的检查,以及是否对错误、遗漏作出纠正;( 5) 监查员每次访视后均要作一书面报告递送研究者,报告应述明监查日期、时间、监查员姓名、监查的发现等,并存档。这样一方面能够保证研究者的积极性,一方面了解受试者的不良反应及其依从性,因此在试验实施阶段,充分调动监查员的积极性,进行每月一次的监查,对于提高试验质量,保障试验顺利完成具有重要意义。
3. 4. 3 加强临床试验药物的管理 药物管理应严格执行“试验药物管理 SOP”,注重细节管理; 接受药物时认真核对标签上的名称、规格、批号、数量等,检查批号是否与药物检验报告单一致。药物管理员严格按照药物随机编号依次分发,以确保临床试验的随机性。根据试验方案的要求设计用药记录卡,并指导受试者记录,试验结束后收回作为原始文件保存,并可依此评价受试者用药的依从性。在回收试验用药时,认真清点,将剩余数量如实记录。可设独立的药品储藏室,并严格做好药物的“三专”管理,即“专人、专柜、专簿”。由各专业设专人负责严格按照试验方案及随机号进行药物的接受、存储及发放回收等,药物储存在专用的储存室及储存柜,以保证药品按照规定的温度、湿度、三防等要求进行储存,同时,用专簿对所有药物的进出进行登记备案。
3. 5 独立的数据管理中心
数据管理中心设立在南京中医药大学附属医院数据管理中心,不直接参与临床试验,对录入的电子病历资料进行核查、锁定、统计和分析等,保证了试验结果的客观性。
3. 6 慎重选择研究分中心
研究分中心的选择很重要,需要考虑受试者来源、地区性甚至种族差异、有关的临床流行病学调查结果、所需协作单位的数量、协作单位的入选条件、协作单位对课题研究的重视程度等因素[12],还要通过其学科发展规模和水平评估可能入组病例的数量,要考察其研究人员结构和同期所承担课题的数量,考察分中心的硬件条件,如是否具备课题研究所需的检测设备,还要考虑对分中心监查和联络的方便。分中心的选择直接影响研究质量和进度,甚至参加单位的网络问题也会导致研究数据上传不及时。因此,在最初选择研究分中心时就应把好关,加强对协作单位的组织管理,在实施过程中出现问题及时处理,在研究进程中如果个别单位各种原因研究进度和质量不能达到课题要求,应及时报告项目组进行调整,重视发挥临床试验分中心的作用,加强协作医院的培训监查工作,为以后课题顺利开展奠定基础。
【关键词】 大规模临床研究;动态管理;中医药
大规模临床试验以样本量大、研究单位多、观察周期长为其主要特征,在跨地区、多个协作单位参加的情况下,如何对试验过程进行有效管理是提高研究质量的保证。国外发达国家大规模临床试验开展较早,同时网络化程度高。国内由于网络、平台、人员等因素,阻碍了临床试验电子化的进程,许多研究单位无法实现网络化,只能实行终点管理的模式。
“芪参益气滴丸对心肌梗死二级预防的临床试验研究”(MISPS-TCM)为国家科技攻关项目,在全国东、西、南、北、中设有14个临床试验分中心,75个参加医院,采用多中心、大样本、随机、双盲双模拟、阳性药平行对照试验的方法,计划纳入4 000例受试者。此项目就目前国内现有的条件,实现了临床研究的动态管理,为研究的整体质量提供了保障。以下将从研究实施、药物运送、数据管理等几个方面阐述。
1 研究实施
MISPS-TCM项目采用中心随机化的方法,各个参加医院的研究者通过拨打电话(许多研究单位无法实现Internet连接),接入临床研究语音应答系统(CRIVRS,中国中医科学院),按照语音提示进行操作,逐步完成对受试者的筛选、随机化和药物指定等工作。如果受试者状态改变(中止或完成试验),也需要及时向系统进行注册。
临床研究者有任何与研究有关的问题都可以通过电话与试验中心联系,试验中心工作人员尽快给予解决,重要问题及时向课题领导小组汇报。临床研究语音应答系统(CRIVRS)与Internet对接,生成入组信息数据库,并提供网上浏览,试验中心人员登陆网站后,可以了解各个中心的进展动态。
2 药物运送
大规模临床试验有其固有的特点,样本量大,观察周期长,这样就不能将所有的药物一次性生产出来,也不能一次将药物运送到每个研究单位,否则就会带来一系列的问题,比如药物有效期、药物浪费、研究单位药物存放等等问题。
MISPS-TCM项目采取了分批生产编盲、分次运送的方法。第一批药物在估算75家单位3个月用量的基础上生产,第一次运到每个单位的药物为36例受试者3个月的用量,以后根据各个研究单位的进度,逐渐补充。当某个单位药物存量达到系统最低限度时,CRIVRS系统将发出药物运送单给药厂管理员,药厂管理员按照清单提供的信息,将药物通过“宅急送”送达各个参加单位,同时将送出的药物编号对系统进行登记,供这个参加单位申请使用。参加医院的药物管理人员收到药品后,同样要对系统进行确认。这样就达到药物运送的动态管理,边使用、边生产、边运送,解决了一系列的问题。
3 数据管理
数据管理贯穿于临床研究的各个环节,大致可分为数据采集、数据录入与统计、报告存档3个阶段,各阶段数据管理侧重点不同,操作方法不同,但目的都是要保证研究数据的质量[1]。前两步对可靠原始资料的获得至关重要。大规模临床试验的研究时间跨度长,研究中心多且分布于各地,样本数量大,包含大量数据的记录、保存、整理等工作,纸型的病历报告表(CRF)如果管理不当,在填写、转交、保存等过程中容易缺失、破损,导致数据丢失,影响数据的完整性。在临床研究中,同样强调对患者当时情况的及时观察与记录,保证信息的准确、真实,因此,必须在规定的时点观察并填写各项数据,否则时效性也得不到保证。
要解决这些问题,必须进行严格的质量控制,而临床资料及时传输是质量控制的重要环节。网上提交是实现数据采集及时性的最理想方法,国外发达国家逐步实现临床研究的电子化,整个研究过程在Internet上实现,基本脱离了纸质材料。国内由于条件的限制,临床研究数据仍以纸质CRF为载体,所以纸质CRF提交仍处于主导地位。MISPS-TCM项目采用传真的方式实现CRF的即时提交,保证资料的时效性。
转贴于
临床试验中心和数据管理中心收到传真资料后,对CRF记录的信息进行初步审查,包括纳入病例是否符合纳入标准、是否有缺项漏项、字迹是否能清晰辨认、有无修改等。将没有疑问的数据录入建好的数据库,并在录入的过程中进一步完善数据库;有疑问的数据填写疑问表,及时交与临床监查员,由临床监查员向临床研究者进行质询核对,修改并签字,说明出现问题原因。随着试验病例资料的传入,同步录入数据,当试验结束后数据库也完成。这样可以随时对数据进行核查,并防止数据在试验结束后被修改,还可以很方便地进行中期分析,及早发现问题,特别是对于多中心的临床试验。通过动态数据管理,边收集、边整理、边核查、边录入,及时纠正发生的问题,为统计分析提供高质量的数据。
4 讨论
随着信息技术的发展,借助信息技术来提高临床试验数据收集和处理的效率、进行试验过程的协调和管理正日益普及。FDA已经开始接受完整的电子化申报资料并对电子申报实行优先评审,促进了临床研究电子化进程。各国的软件开发商已经开发了不少专业的临床数据管理软件,其中较为成熟的有Oracle公司的Clinical, Phase Forward 公司的Clintrial、Clintrace和InForm,国内开发的用于临床数据管理的专业软件ClinAdmin等。这些软件系统具有规范化的研究设计、电子CRF的设计、电子数据获取,全面的临床试验信息管理,在线受试者招募,基于Web技术的加密的数据传输等功能,能够帮助临床研究人员轻松地实现临床试验数据的规范化管理。国内计算机网路技术目前还只是局限于某些环节和某些单位,不能实现“信息流”的全面流通。MISPS-TCM项目立足于国内的具体情况,采用电话网络与Internet对接,实现了大规模临床试验的动态管理,对临床试验中各个环节实施实时的信息交换、数据核查和监管、加强试验中各类研究人员的相互协作,这对有效控制偏倚,进一步提高中医药临床研究质量具有非常积极的作用。